Por EBSCO Multilingual Health Database (for Hospital and Medical Institutions)
· Insuficiencia Cardíaca Congestiva
· Hipertensión
· Corrección de la Deficiencia Relativa Inducida por Medicamentos
El término NUTRACÉUTICO fue acuñado desde “nutrición” y “farmacéutico” en 1989 por el Dr. Stephen DeFelice, Presidente de la Fundación para la Innovación en Medicina (Foundation for Innovation in Medicine, FIM), en Cranfor, Nueva Jersey, Estados Unidos.
El Dr. DeFelice definió la Nutracéutica como “un alimento o parte de un alimento que proporciona beneficios médicos o para la salud, incluyendo la prevención y/o el tratamiento de enfermedades”.
Realmente DeFelice puso nombre a un concepto que venía siendo utilizado por el hombre desde el paleolítico y que ya se encontraba en pleno desarrollo en países industrializados, como por ejemplo Japón, donde no sólo sabían sino que ya utilizaban los alimentos como medicamentos.
“Deja que la comida sea tu medicina y la medicina tu alimento”
Hipócrates, 400 A.C.
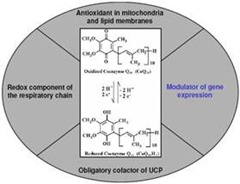
COENZYMA Q10
Principales Usos Nutraceúticos:
· Insuficiencia Cardíaca Congestiva
· Hipertensión
· Corrección de la Deficiencia Relativa Inducida por Medicamentos
Insuficiencia Cardíaca Congestiva (CHF)
Evidencia muy razonable respalda el uso de la CoQ 10 como terapia adyuvante para la insuficiencia cardíaca congestiva. Se piensa que funciona al mejorar la eficiencia del músculo cardíaco.
Un estudio doble ciego multicéntrico dio seguimiento a 641 personas con insuficiencia cardíaca tipo III ó IV de la NYHA durante 1 año.1 A la mitad se le suministró 2 mg/kg de CoQ 10 oralmente y el resto recibió placebo. La terapia convencional no se interrumpió. En el grupo que utilizó Q-10, hubo una reducción estadísticamente significativa y progresiva en el tipo de CHF durante el transcurso del estudio. No fue apreciada mejora en el nivel funcional en el grupo con placebo. También hubo una reducción clínicamente significativa y estadística en la incidencia de edema pulmonar agudo, asma cardíaco y hospitalizaciones en los casos de empeoramiento de la insuficiencia cardíaca en el grupo tratado. Adicional a esto, hubo una reducción estadísticamente significativa en el porcentaje de pacientes que requirieron una o más hospitalizaciones durante el periodo de prueba, de un 40% en el grupo de control a aproximadamente 20% en el grupo de Q-10.
Un estudio doble ciego que incluyó a 197 personas con insuficiencia cardíaca por enfermedad valvular descubrió que 30 mg/al día de CoQ 10 redujeron significativamente los síntomas generales.2 Un estudio escandinavo doble ciego cruzado dio seguimiento a 80 pacientes con CHF durante 6 meses y descubrió beneficios similares.3 Por último, un estudio doble ciego controlado por placebo que incluyó a 22 personas con insuficiencia cardíaca tipo II - III de la NYHA utilizó pruebas invasivas (cateterización del lado derecho del corazón) y documentó una mejoría considerable en el rendimiento de la LV.4
Sin embargo, dos estudios doble ciego bien diseñados, que incluyeron a un total de aproximadamente 85 personas con insuficiencia cardíaca congestiva falló en descubrir alguna evidencia de beneficio, posiblemente debido a un inadecuado poder estadístico.5,54
Hipertensión
Un estudio doble ciego controlado con placebo de 8 semanas de duración en 59 hombres hipertensos que estaban recibiendo tratamiento convencional descubrió que 120 mg de CoQ 10 diarios redujeron la presión arterial sistólica promedio en un 10% y la presión arterial diastólica aproximadamente un 9%, mientras que sólo fueron apreciados cambios insignificantes en el grupo con placebo.6
Además, un estudio doble ciego de 12 semanas de duración que incluyó a 83 personas con hipertensión aislada sistólica descubrió mejoras en grupo de CoQ 10 con (60 mg al día) en comparación con el grupo con placebo.52
De manera similar, en un estudio doble ciego controlado con placebo de 12 semanas de duración que incluyó a 74 personas con diabetes, el uso de CoQ 10 en una dosis de 100 mg dos veces al día redujo considerablemente la presión arterial en comparación con el grupo placebo.59
También fueron observadas mejoras significativas en la presión arterial sistólica y diastólica en un pequeño (n=18) estudio doble ciego cruzado de CoQ 10 con periodos de 10 semanas de tratamiento.7
Corrección de la Deficiencia Relativa Inducida por Medicamentos
Alguna evidencia sugiere que una variedad de medicamentos podrían provocar deficiencia de CoQ 10 o interferir con su acción. Se ha sugerido (pero no probado) que esta deficiencia de CoQ 10 o su inhibición podrían influir en los conocidos efectos secundarios de estos tratamientos y que los complementos de CoQ 10 podrían ser benéficos.
La mejor evidencia considera a los agentes de la familia de las estatinas. La reductasa HMG-CoA es necesaria para la síntesis tanto del colesterol como de la CoQ 10; por esta razón se esperaría que los medicamentos con estatina redujeran los niveles de CoQ 10.
Un estudio aleatorio doble ciego controlado por placebo que incluyó a 45 pacientes hipercolesterolémicos que tomaron lovastatina o pravastina durante un periodo de 18 semanas, descubrió una disminución significativa relacionada con la dosis de los niveles totales de CoQ en plasma 10 asociados con ambos medicamentos.16 De manera similar, un estudio doble ciego controlado con placebo de 3 meses de duración descubrió que el tratamiento con simvastatina o pravastatina 20 mg/al día disminuyó los niveles de CoQ 10 en el plasma en 30 pacientes hipercolesterolémicos así como en 10 voluntarios normales.17
Estas reducciones (aproximadamente del 30 al 50%) podrían ser clínicamente significativas.18 Cinco pacientes hospitalizados (de entre 43 y 72 años de edad) con cardiomiopatía que fueron tratados con lovastatina mostraron una disminución de los niveles de CoQ 10 en la sangre y deterioro del funcionamiento cardíaco, incluyendo empeoramiento de la fracción eyectora. Una complementación posterior oral con CoQ 10 (de 100 a 200 mg/diarios) llevó a un incremento de los niveles de CoQ 10 en la sangre y a una reversión del deterioro cardíaco.
Otro estudio descubrió que el complemento de CoQ 10 podía prevenir la reducción de CoQ 10 tanto en el plasma como en las plaquetas sin afectar el efecto terapéutico de la simvastatina.19
Para otras varias categorías de medicamentos, la evidencia es más indirecta, girando en torno a información que encuentra la inhibición de las enzimas relacionada con la producción o acción de la CoQ 10. Esta supuesta disminución o interferencia con la CoQ 10 inducida por los medicamentos incluye las sulfonilureas (dimelor, gliburide y tolazamida; la tolbutamida, glipizida y clorpropamida podrían ser relativamente no inhibitorias), los bloqueadores beta (propanolol, metoprolol y alprenolol; el timolol fue relativamente no inhibitorio), las fenotiazinas, los antidepresivos tricíclicos (el complemento de CoQ 10 podría tener un efecto protector en contra de los efectos secundarios cardíacos), la diazoxida, la hidroclorotiazida, la clonidina y la hidralazina.20 - 24
Dosis
La dosis regular de CoQ 10 oscila de 30 a 150 mg/diarios, suministrados en dos o tres dosis divididas en los niveles más altos. Esta sustancia soluble en grasa se cree que es mejor absorbida cuando es tomada en forma de gel suave a base de aceite.48
Temas de Seguridad
En estudios en humanos, el uso de la CoQ 10 sólo ha sido asociado con efectos secundarios ligeros no especificados, como malestar gastrointestinal. Varios estudios de la CoQ 10 de 1 a 6 años de duración no han reportado efectos secundarios de consideración, intolerancia, interacciones con medicamentos o intoxicación.1,25, 49 Sin embargo, han habido reportes anecdóticos de síndrome de abstinencia con CoQ 10 en la CHF, provocando un empeoramiento temporal de la insuficiencia cardíaca.
Las dosis máximas de seguridad en personas con enfermedad renal o hepática grave aún no se conocen.
Seguridad en los Niños Pequeños y en las Mujeres Embarazadas o Lactando
No se han establecido las dosis máximas seguras para las mujeres embarazadas o lactando, así como en niños pequeños.
Interacciones con Otros Medicamentos
Una reducción de glucosa en ayunas utilizando CoQ 10 fue observada en un estudio.6 Por lo tanto, es posible que las personas que toman medicamentos hipoglucémicos puedan tener la necesidad de reducir su dosis, aunque esto no ha sido reportado.
Varios estudios han descubierto una reducción de los niveles en plasma de CoQ 10 con la terapia de medicamentos con estatinas.16,17,19 Además, evidencia menos convincente sugiere que otros medicamentos podrían interferir con la síntesis de CoQ 10 o dañar la actividad de las enzimas que contienen CoQ 10; estos medicamentos incluyen bloqueadores beta, clonidina, hidralazina, metildopa, diazoxida, sulfonilureas, fenotiazinas, antidepresivos tricíclicos y diuréticos de tiazida.20 - 24,50 Con este fundamento, la CoQ 10 ha sido recomendada como un complemento útil para las personas que toman estos medicamentos, pero hasta el momento existe poca evidencia de algún beneficio específico.
Un estudio en animales sugiere que la CoQ 10 puede prolongar los efectos de los antihipertensivos enalapril y nitrendipina sin incrementar su máximo efecto hipotensivo.51
La estructura química de la CoQ 10 se asemeja a la de la vitamina K. Basándose en esto, se ha sugerido que la CoQ 10 podría contrarrestar los efectos anticoagulantes de la warfarina.55,56 Sin embargo, un pequeño estudio doble ciego controlado con placebo no descubrió evidencia de la supuesta interacción.57
References [ + ]
1. Morisco C, Trimarco B, Condorelli M. Effect of coenzyme Q10 therapy in patients with congestive heart failure: a long-term multicenter randomized study. Clin Investig. 1993;71(8 suppl):S134-S136.
2. Hashiba K, Kuramoto K, Ishimi Z, et al. Coenzyme-Q10 for treatment of aneurysm [in Japanese]. Heart (Japanese). 1972;4:1579-1589.
3. Hofman-Bang C, Rehnquist N, Swedberg K, et al. Coenzyme Q10 as an adjunctive in treatment of congestive heart failure [abstract]. J Am Coll Cardiol. 1992;19:216A.
4. Munkholm H, Hansen HH, Rasmussen K. Coenzyme Q10 treatment in serious heart failure. Biofactors. 1999;9:285-289.
5. Khatta M, Alexander BS, Krichten CM, et al. The effect of coenzyme Q10 in patients with congestive heart failure. Ann Intern Med. 2000;132:636-640.
6. Singh RB, Niaz MA, Rastogi SS, et al. Effect of hydrosoluble coenzyme Q10 on blood pressures and insulin resistance in hypertensive patients with coronary artery disease. J Hum Hypertens. 1999;13:203-208.
7. Digiesi V, Cantini F, Brodbeck B. Effect of coenzyme Q10 on essential arterial hypertension. Curr Ther Res. 1990;47:841-845.
8. Birnbaum Y, Hale SL, Kloner RA. The effect of coenzyme Q10 on infarct size in a rabbit model of ischemia/reperfusion. Cardiovasc Res. 1996;32:861-868.
9. Hano O, Thompson-Gorman S, Zweifer J, et al. Coenzyme Q10 enhances cardiac functional and metabolic recovery and reduces Ca2+ overload during postischemic reperfusion. Am J Physiol. 1994;266:H2174-H2181.
10. Matsushima T,Sueda T, Matsuura Y, et al. Protection by coenzyme Q10 of canine myocardial reperfusion injury after preservation. J Thorac Cardiovasc Surg. 1992;103:945-951.
11. Rosenfeldt FL, Pepe S, Ou R, et al. Coenzyme Q10 improves the tolerance of the senescent myocardium to aerobic and ischemic stress: studies in rats and in human atrial tissue. Biofactors. 1999;9:291-299.
12. Taggart DP, Jenkins M, Hooper J, et al. Effects of short-term supplementation with coenzyme Q10 on myocardial protection during cardiac operations. Ann Thorac Surg. 1996;61:829-833.
13. Chello M, Mastroroberto P, Romano R, et al. Protection by coenzyme Q10 from myocardial reperfusion injury during coronary artery bypass grafting. Ann Thorac Surg. 1994;58:1427-1432.
14. Judy WV, Stogsdill WW, Folkers K. Myocardial preservation by therapy with coenzyme Q10 during heart surgery. Clin Investig. 1993;71(8 Suppl):S155-S161.
15. Chen YF, Lin YT, We SC, et al. Effectiveness of coenzyme Q10 on myocardial preservation during hypothermic cardioplegic arrest. J Thorac Cardiovasc Surg. 1994;107:242-247.
16. Mortensen SA, Leth A, Agner E, et al. Dose-related decrease of serum coenzyme Q10 during treatment with HMG-CoA reductase inhibitors. Mol Aspects Med. 1997;18 (suppl):S137-S144.
17. Ghirlanda G, Oradei A, Manto A, et al. Evidence of plasma CoQ10-lowering effect by HMG-CoA reductase inhibitors: a double-blind, placebo-controlled study. J Clin Pharmacol. 1993;33:226-229.
18. Folkers K, Langsjoen P, Willis R, et al. Lovastatin decreases coenzyme Q levels in humans. Proc Natl Acad Sci U S A. 1990;87:8931-8934.
19. Bargossi AM, Battino M, Gaddi A, et al. Exogenous CoQ10 preserves plasma ubiquinone levels in patients treated with 3-hydroxy-3-methylglutaryl coenzyme A reductase inhibitors. Int J Clin Lab Res. 1994;24:171-176.
20. Kishi T, Kishi H, Watanabe T, Folkers K. Bioenergetics in clinical medicine. XI. Studies on coenzyme Q and diabetes mellitus. J Med. 1976;7:307-321.
21. Kishi T, Watanabe T, Folkers K. Bioenergetics in clinical medicine XV. Inhibition of coenzyme Q10-enzymes by clinically used adrenergic blockers of beta-receptors. Res Commun Chem Pathol Pharmacol. 1977;17:157-164.
22. Kishi T, Makino K, Okamoto T, et al. Inhibition of myocardial respiration by psychotherapeutic drugs and prevention by coenzyme Q. Biomed Clin Aspects Coenzyme Q. 1980;2:139-157.
23. Kishi H, Kishi T, Folkers K. Bioenergetics in clinical medicine. III. Inhibition of coenzyme Q10-enzymes by clinically used anti-hypertensive drugs. Res Commun Chem Pathol Pharmacol. 1975;12:533-540.
24. Folkers K. Basic chemical research on coenzyme Q10 and integrated clinical research on therapy of diseases. Biomed Clin Aspects Coenzyme Q. 1985;5:457-478.
25. Langsjoen PH, Langsjoen PH, Foilkers K. A six-year clinical study of therapy of cardiomyopathy with coenzyme Q10. Int J Tissue React. 1990;12:169-171.
26. Judy WV. Myocardial effects of coenzyme Q10 in primary heart failure. Biomed Clin Aspects Coenzyme Q. 1984;4:281-290.
27. Manzoli U, Rossi E, Littarru GP, et al. Coenzyme Q10 in dilated cardiomyopathy. Int J Tissue React. 1990;12:173-178.
28. Langsjoen PH, Vadhhanavikit S, Folkers K. Response of patients in classes III and IV of cardiomyopathy to therapy in a blind and crossover trial with coenzyme Q10. Proc Natl Acad Sci. 1985;82:4240-4244 begin_of_the_skype_highlighting 4240-4244 end_of_the_skype_highlighting.
29. Permanetter B, Rossy W, Klein G, et al. Ubiquinone (coenzyme Q10) in the long-term treatment of idiopathic dilated cardiomyopathy. Eur Heart J. 1992;13:1528-1533.
30. Combs AB, Choe JY, Truong DH, et al. Reduction by coenzyme Q10 of the acute toxicity of adriamycin in mice. Res Commun Chem Pathol Pharmacol. 1977;18:565-568.
31. Judy WV, Hall JH, Dugan W, et al. Coenzyme Q10 reduction of Adriamycin cardiotoxicity. Biomed Clin Aspects Coenzyme Q. 1984;4:231-241.
32. Sugiyama S, Yamada K, Hayakawa M, et al. Approaches that mitigate doxorubicin-induced delayed adverse effects on mitochondrial functions in rat hearts; Liposome-encapsulated doxorubican or combination therapy with antioxidant. Biochem Mol Biol Int. 1995;36:1001-1007.
33. Braun B, Clarkson M, Freedson PS, et al. Effects of coenzyme Q10 supplementation on exercise performance, VO2 max and lipid peroxidation in trained cyclists. Int J Sport Nutr. 1991;1:353-365.
34. Snider IP, Bazarre TL, Murdoch SD, et al. Effects of coenzyme athletic performance system as an ergogenic aid on endurance performances to exhaustion. Int J Sport Nutr. 1992;2:272-286.
35. Porter DA, Costill DL, Zachwieja JJ, et al. The effect of oral coenzyme Q10 on the exercise tolerance of middle-aged, untrained men. Int J Sports Med. 1995;16:421-427.
36. Malm C, Svensson M, Ekblom B, et al. Effects of ubiquinone-10 supplementation and high intensity training on physical performance in humans. Acta Physiol Scand. 1997;161:379-984.
37. Weston SB, Zhou S, Weatherby RP, et al. Does exogenous coenzyme Q10 affect aerobic capacity in endurance athletes? Int J Sport Nutr. 1997;7:197-206.
38. Zuliani U, Bonetti A, Campana M, et al. The influence of ubiquinone (Co Q10) on the metabolic response to work. J Sports Med Phys Fitness. 1989;29:57-62.
39. Ylikoski T, Piirainen J, Hanninen O, et al.. The effect of coenzyme Q10 on the exericise performance of cross-country skiers. Mol Aspects Med. 1997;18 (suppl):S283-S290.
40. Barbieri B, Lund B, Lundstrom B, et al. Coenzyme Q10 administration increases antibody titer in hepatitis B vaccinated volunteers - a single blind placebo-controlled and randomized clinical study. Biofactors. 1999;9:351-357.
41. Folkers K, Watanabe T. Bioenergetics in clinical medicine-X. Survey of the adjunctive use of coenzyme Q with oral therapy in treating periodontal disease. J Med. 1977;8:333-348.
42. Iwamoto Y, Watanabe T, Okamoto H, et al. Clinical effect of coenzyme Q10 on periodontal disease. Biomed Clin Aspects Coenzyme Q. 1981;3:109-119.
43. Watts TL. Coenzyme Q10 and periodontal treatment: is there any beneficial effect? Br Dent J. 1995;178:209-213.
44. Folkers K, Simonsen R. Two successful double-blind trials with coenzyme Q10 (vitamin Q10) on muscular dystrophies and neurogenic atrophies. Biochim Biophys Acta. 1995;1271:281-286.
45. Huntington Study Group. A randomized, placebo-controlled trial of coenzyme Q(10) and remacemide in Huntington's disease. Neurology. 2001;57:397-404.
46. Kitamura N, Yamaguchi A, Otaki M, et al. Myocarial tissue level of coenzyme Q10 in patients with cardiac failure. Biomed Clin Aspects Coenzyme Q. 1984;4:243-252.
47. Mortensen SA, Vadhanavikit S, Muratsu K, et al. Coenzyme Q10: clinical benefits with biochemical correlates suggesting a scientific breakthrough in the management of chronic heart failure. Int J Tissue React. 1990;12:155-162.
48. Weis M, Mortensen SA, Rassing MR, et al. Bioavailability of four oral coenzyme Q10 formulations in healthy volunteers. Mol Aspects Med. 1994;15(suppl):S273-S280.
49. Baggio E, Gandini R, Plancher AC, et al. Italian multicenter study on the safety and efficacy of coenzyme Q10 as adjunctive therapy in heart failure. CoQ10 Drug Surveillance Investigators. Mol Aspects Med. 1994;15(suppl):S287-S294.
50. Hamada M, Kazatain Y, Ochi T, et al. Correlation between serum CoQ10 level and myocardial contractility in hypertensive patients. Biomed Clin Aspects Coenzyme Q. 1984;4:263-270.
51. Danysz A, Oledzka K, Bukowska-Kiliszek M. Influence of coenzyme Q-10 on the hypotensive effects of enalapril and nitrendipine in spontaneously hypertensive rats. Pol J Pharmacol. 1994;46:457-461.
52. Burke BE, Neuenschwander R, Olson RD. Randomized, double-blind, placebo-controlled trial of coenzyme Q10 in isolated systolic hypertension. South Med J. 2001;94:1112 - 1117.
53. Singh RB, Khanna HK, Niaz MA. Randomized, double-blind placebo-controlled trial of coenzyme Q10 in chronic renal failure: discovery of a new role. J Nutr Environ Med. 2000;10:281-288.
54. Watson PS, Scalia GM, Galbraith A, et al. Lack of effect of coenzyme Q10 on left ventricular function in patients with congestive heart failure. J Am Coll Cardiol. 1999;33:1549-1552.
55. Spigset O. Reduced effect of warfarin caused by ubidecarenone [letter]. Lancet. 1994;344:1372 - 1373.
56. Combs AB, Porter TH, Folkers K. Anticoagulant activity of a naphtoquinone analog of vitamin K and an inhibitor of coenzyme Q10-enzyme systems. Res Commun Chem Pathol Pharmacol. 1976;13:109 - 114.
57. Engelsen J, Nielsen JD, Winther K. Effect of coenzyme Q10 and Ginkgo biloba on warfarin dosage in stable, long-term warfarin treated outpatients. A randomised, double-blind, placebo-crossover trial. Thromb Haemost. 2002;87:1075-1076.
58. Shults CW, Oakes D, Kieburtz K, et al. Effects of coenzyme Q10 in early Parkinson disease: evidence of slowing of the functional decline. Arch Neurol. 2002;59:1541-1550.
59. Hodgson JM, Watts GF, Playford DA, et al. Coenzyme Q(10) improves blood pressure and glycaemic control: a controlled trial in subjects with type 2 diabetes. Eur J Clin Nutr. 2002;56:1137-1142.
60. Eriksson JG, Forsen TJ, Mortensen SA, et al. The effect of coenzyme Q 10 administration on metabolic control in patients with type 2 diabetes mellitus. Biofactors. 1999;9:315 - 318.
Ultima revisión Enero 2003 por EBSCO CAM Editorial Board
El contenido en este sitio es revisado periódicamente y es actualizado cuando nuevas evidencia son publicadas y resultan relevantes. Esta información no pretende ni será nunca el sustituto del consejo emitido por un profesional de la salud. Siempre busque el consejo de un doctor u otra persona calificada antes de iniciar cualquier nuevo tratamiento, o si tiene dudas respecto a una condición médica.
· To send comments or feedback to our Editorial Team regarding the content please email us at healthlibrarysupport@ebscohost.com.














0 comentarios:
Publicar un comentario